
|




| 产地 | 中国 |
| 品牌 | XYBIO |
| 货号 | 011203 |
| 用途 | 科研 |
| 包装规格 | 96T |
| 纯度 | 100% |
| CAS编号 | |
| 是否进口 | 否 |
五种致泻性大肠埃希氏菌鉴定试剂盒(PCR法)
产品说明
病菌检测系列可针对食品、饲料等样品中的致病微生物的特异核酸片段进行扩增,仪器实时监测扩增过程中的荧光信号变化,自动判读结果。本产品用于致-泻大肠埃希氏菌的检测。检出限为10^3 CFU/ml。
产品组成(96 测试)

所需仪器
ABI ,BioRad,TaKaRa等 PCR扩增仪,电泳仪,凝胶成像仪等电泳配套设备。(使用荧光定量 PCR仪进行定性判读时则无需电泳设备)自备耗材和仪器
①灭菌 1.5mL或 2.0mL离心管 ;②冰盒 ;③移液器 (0.5-10μL,10-100μL,100-1000μL)及配套灭菌吸头 ;④ 离心机; ⑤涡旋混匀器; ⑥金属浴。
◆ 样品处理
参照 《GB4789.6—2016 食品安全国家标准 食品微生物学检验 致-泻大肠埃希氏菌检验 》中的操作步骤进行前增菌。建议使用试剂配套细菌基因组 DNA提取系列产品。
◆ 实验操作
1.试剂配制 (试剂配制 区,放置于冰盒中进行)取出各管试剂 ,将试剂完全解冻 ,离心 30s。取 12×(所待检样品数 +3)的 PCR反应管 ,按 12个一组排列 并编 号,依次 向各管中 加入 23μL 的 12种反应液 。
2.添加模板(样本制备区,放置于冰盒中进行)向每管反应液中分别加入2μL模板 (或直接使用无菌吸头挑取少许待检菌落至反应管中 )。
加样示例:(有N个待测样品)取(N+3)组 12个一组 的反应管 ,按顺序 组 12管中 全部加 入 2μL的 NG-DW, 组 12管中 全部加 入 2μL
的 NG-Ecoli,第三 组 12管中 全部加 入 2μL的样品 1模板 ,第四 组 12管中 全部加 入 2μL的样品 2模板 ,…, 组 12管中 全部加 入 2μL的 PG-Ecoli。盖好 PCR管盖后,涡旋混匀 30s,离心 1min,立即进行 PCR扩增反应。
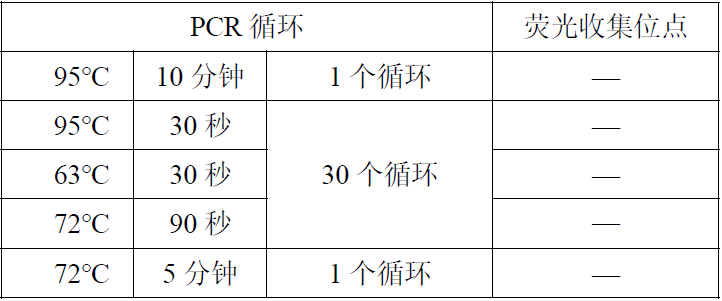
3.扩增反应(扩增及产物分析区)
按下列条件设置扩增反应:
4. 产物电泳(扩增及产物分析区)
称量 4. 0g 琼脂糖粉,加入至200 mL 的1×TAE 电泳缓冲液中,充分混匀。使用微波炉反复加热至沸腾,直到琼脂糖粉完全融化形成清亮透明的溶液。待琼脂糖溶液冷却至60℃右时,加入溴化乙锭( EB )至终浓度为0.5μg/mL,充分混匀后,轻轻倒入已放置好梳子的模具中,凝胶长度要大于 10cm,厚度宜为 3mm~5mm。检查梳齿下或梳齿间有无气泡,用一次性吸头小心排掉琼脂糖凝胶中的气泡。当琼脂糖凝胶完全凝结硬化后,轻轻拔出梳子,小心将胶块和胶床放入电泳槽中,样品孔放置在阴 。向电泳槽中加入 1×TAE 电泳缓冲液,液面高于胶面 1mm~2mm。将 5μL PCR 产物与1μL 6×上样缓冲液混匀后,用微量移液器吸取混合液垂直伸入液面下胶孔,小心上样于孔中;阳性对照的 PCR 反应产物加入到 一个泳道; 个泳道中加入 2 μ L 分子量 Marker 。接通电泳仪电源,根据公式:电压=电泳槽正负极间的距离(cm)×5V/cm 计算并设定电泳仪电压数值;启动电压开关,电泳开始以正负极铂金丝出现气泡为准。电泳 30min~45min 后,切断电源。取出凝胶放入凝胶成像仪中观察结果,拍照并记录数据。
可使用 Gold view、Gal-Rad 等等效的核酸荧光染料替代 EB。
推荐使用 DNA Marker:DL2000 或 100bp ladder,等可指示 100bp~1500bp 条带的 Marker。
◆ 结果分析
1. 阴阳性判读:
进行电泳检测时,需对比 Marker 进行判断,当目的靶标对应位置出现单一显著条带时可判断该靶标为阳性;
否则为该靶标检测为阴性。

示例电泳图
2. 有效性判读:
需同时满足:1.空白对照中所有泳道均为阴性;2.阴性对照中 uidA 泳道阳性,其余泳道阴性;2.阳性对照中所有泳道阳性,此时可判断实验有效。如无法满足上述条件,则实验无效,需重复实验;如重复后结果仍为无效,请于本公司技术支持联系。
3. 结果判读:
在实验有效的情况下,可根据下表进行判读:

97%以上大肠埃希氏菌为 uidA 阳性,可参考阴性对照中该基因检测结果判断扩增效果;
当结果判定为EPEC 阳性时,若 bfpB 靶标为阳性则说明样品含有典型EPEC;若 bfpB 靶标为阴性则说明样品为非典型EPEC;
当结果判定为STEC/EHEC 阳性时,若eae 靶标为阳性则说明样品含有典型EHEC;若 eae 靶标为阴性则说明样品为非典型EHEC。
企业信息
上海晅科生物科技有限公司